可诊可治可预防的罕见病——原发性肉碱缺乏症
2024年1月19日,仅4月龄的女孩澜澜(化名)因“咳嗽2天,嗜睡1天,发热半天,反复抽搐10余次”入院PICU。查体:神嗜睡,对疼痛刺激没有反应,面欠红润,腹膨隆,肝脏肋下扪及6cm。化验:血糖显著降低(0.7mmol/L),血氨显著升高(393umol/L),尿酮体(+),血清AST、ALT显著升高。医生对其进行了补糖、抗感染等治疗,澜澜很快有了意识,然而,在诊疗中,医务人员发现患儿存在呼吸、消化、神经、内分泌等多系统损害,很难用肺炎等常见疾病来解释,故邀请小儿遗传代谢内分泌科会诊。“考虑到患儿低血糖、肝大伴肝功异常、高血氨、频繁抽搐并出现意识障碍,推测澜澜可能患上一种罕见的遗传代谢病。”四川省妇幼保健院小儿内科罗泽民主任医师说。随后对患儿进行了血串联质谱分析和遗传代谢病基因检测。
三天后,血串联质谱结果显示:患儿存在严重的肉碱缺乏,游离肉碱C0为0.54umol/L(正常范围8.5—60umol/L),低于下限值;同时乙酰基肉碱C2、辛酰基肉碱C8、十六烷酰基肉碱C16、十八烷酰基肉碱C18均降低,氨基酸谱均正常(图1)。根据血串联质谱分析结果,临床诊断为原发性肉碱缺乏症,按照2019年国家卫健委罕见病诊疗指南和国内外相关的诊疗建议,给予大剂量左卡尼汀(左旋肉碱)替代治疗。半月后基因结果显示:患儿在SLC22A5基因上检出“c.760C>T,c.338G>A”复合杂合致病性变异,该基因与“原发性肉碱缺乏症”相关(图2)。经过1周的左卡尼汀补充,澜澜病情明显好转,肝脏回缩,肝功好转,再次复查血串联质谱,结果显示游离肉碱为18.49umol/L以及多种酰基肉碱指标已恢复正常范围,治疗效果良好(图3)。医生建议继续补充左卡尼汀,半月后再行复查,游离肉碱处于正常范围(图4),各项临床指标也相继恢复正常于近日出院,医生建议需长期口服左卡尼汀,定期随访,关注澜澜体内游离肉碱水平以及生长发育情况。
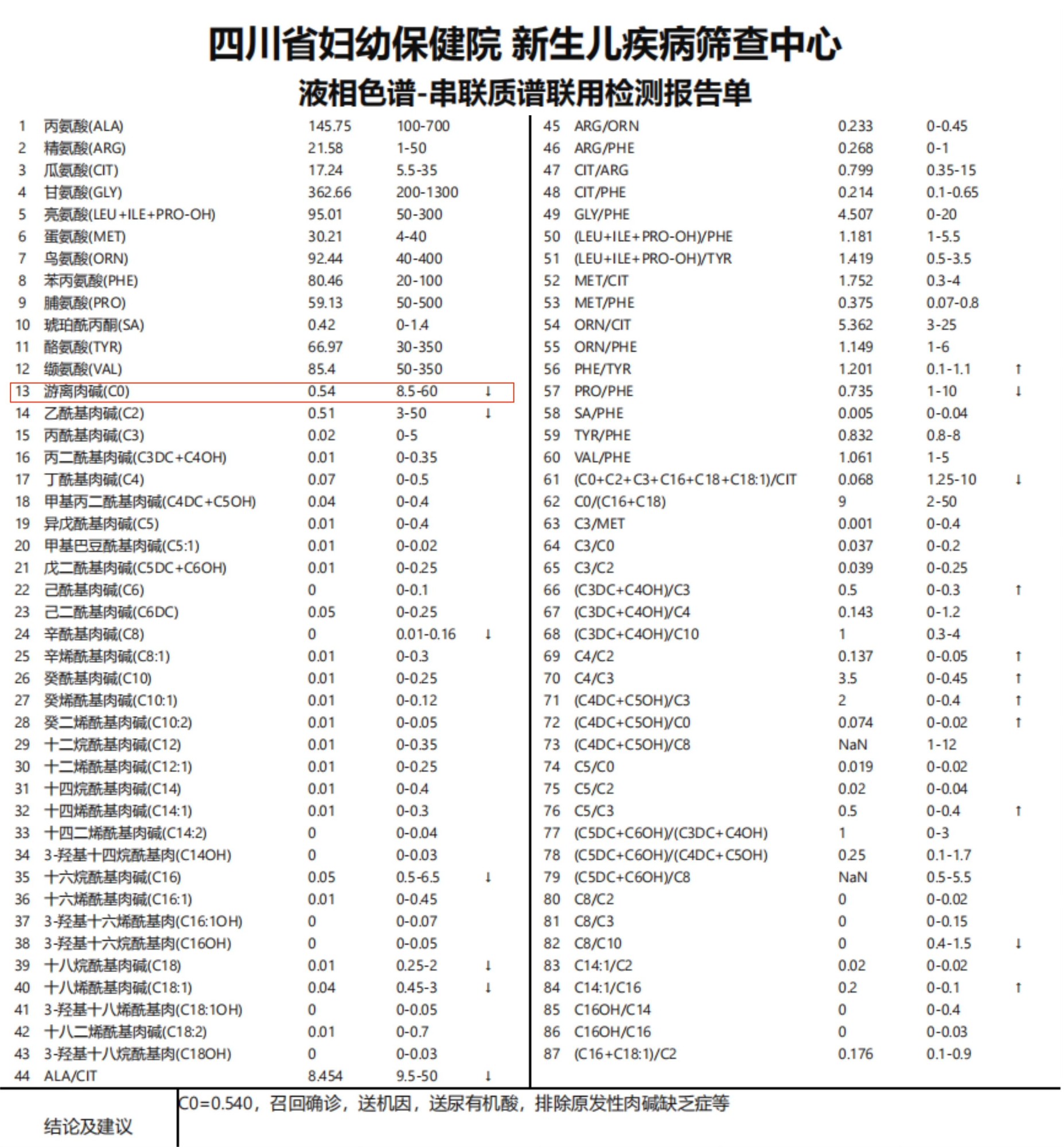
图1 首次串联质谱分析报告
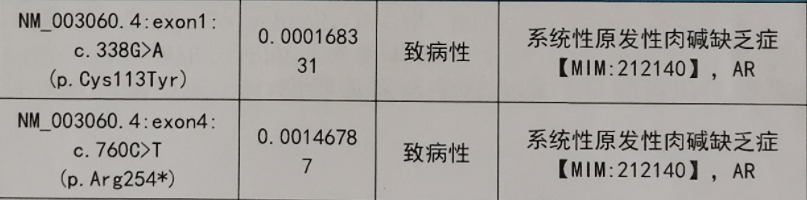
图2 常见遗传代谢病基因筛查结果

图3 第二次串联质谱分析报告,截取游离肉碱指标

图4 第三次串联质谱分析报告,截取游离肉碱指标
一、什么是原发性肉碱缺乏症?
原发性肉碱缺乏症(primary carnitine deficiency,PCD)又称肉碱转运障碍或肉碱摄取障碍,是一种常染色体隐性遗传病,表现为血浆肉碱水平明显降低及组织细胞内肉碱缺乏,引起心脏、骨骼肌、肝脏等多系统损害[1]。1975年该病被首次报道[2],1988年揭示了该病的病因,同年PCD的基因被定位并克隆,随后一系列的突变位点被识别。不同国家的PCD患病率从1:40000到1:120000不等,人群中杂合子的发生率为0.5%~1%,我国的患病率约为1/24000,属于患病率比较高的遗传代谢病[3]。
PCD被认为是一种潜在的致死性疾病,患儿可因急性能量代谢障碍危象或急性心衰而猝死。由于PCD患儿临床表现多数无特异性,起病年龄、受累脏器及严重程度在不同的个体存在明显的差异,临床容易漏诊或误诊。多数患儿在3个月~2岁发病,因应激状态(如上呼吸道感染、胃肠炎等引起的饥饿、高代谢状态)诱发,表现为喂养困难、呕吐、意识障碍、肝肿大、低酮性低血糖、肝酶增高、高氨血症等急性能量代谢障碍危象,或出现肝脏损害,表现为肝大、肝功能异常等表现。一些肝损患儿急性起病,表现为抽搐、进行性意识障碍等。相对晚发病的患者可出现心肌病,表现为心室肥厚、心功能不全及肌酸激酶升高等;或肌病,表现为肌无力、肌张力减退、肌痛、运动耐力差、肌纤维内脂质沉积等。另外一部分患儿还有一些其他不典型的临床表现包括:反复恶心、腹痛、贫血、近端肌无力和发育迟缓、呼吸窘迫、智力运动落后、精神行为异常、易感染等。而携带者多无症状[1,4]。
二、PCD如何诊断?
目前串联质谱(MS/MS)能够对血液中游离肉碱(C0)及不同种类酰基肉碱进行快速、特异及准确地检测。故可采集足跟血或静脉血,滴于专用滤纸片上晾干,寄送到新生儿疾病筛查中心进行检查,PCD患者血游离肉碱及多种酰基肉碱水平会降低。
值得注意的是,游离肉碱能通过胎盘从母体转运给胎儿,若母亲体内肉碱充足,则新生儿出生后一段时间内仍保持较充足的肉碱储备,导致筛查出现假阴性,故筛查阴性患儿也需定期儿保检查,关注生长发育情况。另外,若母亲为原发性肉碱缺乏症或各种原因导致血液中肉碱不足,也会导致新生儿筛查时血游离肉碱水平低于正常,导致假阳性,故新生儿筛查阳性者,需要同时测母亲血游离肉碱水平,以便除外继发性肉碱缺乏[4]。(图5)
此外,基因检测可见原发性肉碱缺乏症(PCD)致病基因SLC22A5存在基因突变,同时根据基因结果可与继发性肉碱缺乏症进行鉴别诊断。

图5 诊断建议
三、PCD如何治疗?
PCD是一种可诊可治可防的罕见病,早期诊断及治疗对于改善预后极其重要。治疗原则是避免饥饿及长时间高强度运动,新生儿期喂养间隔时间不超过2—3小时,婴儿不超过4—6小时,儿童不超过6小时。患者需终身补充肉碱(左卡尼汀)替代治疗,维持血浆游离肉碱水平正常或接近正常。
四、PCD如何预防?
1.有阳性家族史的夫妇进行基因检测,对其胎儿进行产前诊断,避免患儿的出生。
2.没有家族史的夫妇,孩子也可能患此病,因为原发性肉碱缺乏症属于常染色体隐形遗传,其特征为致病基因携带者的一对基因中有一条异常,另一条正常,而这条正常基因所发挥的作用足以掩盖致病基因的作用,因而携带者本人身体健康并不发病,但致病基因会传递给后代。当父母双方都是携带者时,每次怀孕胎儿就有25%的机会从父母双方各自获得致病基因而患病,有50%的机会如父母一样为携带者,只有25%的机会完全正常(图6)。
3.及时进行串联质谱筛查,做到早诊断早治疗,预防患儿发病及猝死。PCD疑似患者,一旦确诊,立即治疗,防止不可逆病变的发生。
4.PCD患者需定期随访血浆游离肉碱及酰基肉碱水平,定期进行心、肝、骨骼肌功能检查及各方面发育评估,全面了解病情进展,便于及时调整药物剂量,维持血浆肉碱水平及病情的稳定。
5.终身补充肉碱(左卡尼汀)替代治疗,患者切忌自行更改药物剂量或停药,有因自行停药而出现反复低血糖猝死的报道。
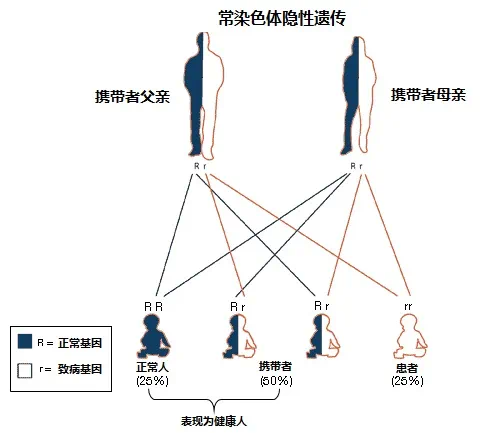
图6 常染色体隐形遗传模式图
参考文献
[1] 顾学范.临床遗传代谢病[M].北京:人民卫生出版社,2015:135-137.
[2] Karpati G,Carpenter S, Engel AG, Watters G, Allen J, Rothman S, Klassen G, Mamer OA. The syndrome of systemic carnitine deficiency. Clinical, morphologic, biochemical,and pathophysiologic features. Neurology[J]. 1975, 25(1): 16-24.
[3]韩连书,叶军,邱文娟,张惠文,王瑜,季文君,高晓岚,李晓燕,金晶,顾学范. 原发性肉碱缺乏症17例诊治与随访[J]. 中华儿科杂志,2012,06:405-409.
[4] 中华预防医学会出生缺陷预防与控制专业委员会新生儿遗传代谢病筛查学组等. 原发性肉碱缺乏症筛查与诊治共识[J]. 中华医学杂志, 2019, 99(2): 88-92.
医师简介:
罗泽民,主任医师,小儿内科副主任兼小儿神经/遗传代谢内分泌(新生儿疾病)科专科主任,擅长:小儿神经及遗传代谢内分泌疾病诊治及罕见病会诊。
门诊时间:晋阳院区周一、六全天,周三上午,周四下午(特需门诊)
欧明才,主任医师,四川省妇幼保健院新生儿疾病筛查中心办公室副主任,擅长小儿遗传代谢内分泌疾病诊治及罕见病诊治。
门诊时间:晋阳院区周一、二、四、六上午
章阿元,小儿内分泌博士,主治医师,擅长小儿遗传代谢内分泌疾病诊治及危重症诊治。
门诊时间:晋阳院区周二全天、周四上午









